2014年11月25日に「再生医療等安全性確保法」が施行されたことにより、患者の血液を採取・遠心分離して作製されるPRP療法につきましても、法の対象となることが決定しており、各クリニックにおいて届出等の手続きが必要となりました。
再生医療等安全性確保法
趣旨
再生医療等の迅速かつ安全な提供等を図るため、再生医療等を提供しようとする者が講ずべき措置を明らかにするとともに、特定細胞加工物の製造の許可等の制度等を定める。
内容
- 再生医療等の分類
再生医療等について、人の生命及び健康に与える影響の程度に応じ、「第1種再生医療等」「第2種再生医療等」「第3種再生医療等」に3分類して、それぞれ必要な手続を定める。 - 再生医療等の提供に係る手続
○ 第1種再生医療等提供計画について、特定認定再生医療等委員会の意見を聴いた上で、厚生労働大臣に提出して実施。
一定期間の実施制限期間を設け、その期間内に、厚生労働大臣が厚生科学審議会の意見を聴いて安全性等について確認。安全性等の基準に適合していないときは、計画の変更を命令。
○ 第2種再生医療等提供計画について、特定認定再生医療等委員会の意見を聴いた上で、厚生労働大臣に提出して実施。
○ 第3種再生医療等提供計画について、認定再生医療等委員会の意見を聴いた上で、厚生労働大臣に提出して実施。
※ 特定認定再生医療等委員会は、特に高度な審査能力と第三者性を有するもの。
※ 第1種再生医療等、第2種再生医療等を提供する医療機関については、一定の施設・人員要件を課す。 - 適正な提供のための措置等
○ インフォームド・コンセント、個人情報保護のための措置等について定める。
○ 疾病等の発生は、厚生労働大臣へ報告。厚生労働大臣は、厚生科学審議会の意見を聴いて、必要な措置をとる。
○ 安全性確保等のため必要なときは、改善命令を実施。改善命令違反の場合は再生医療等の提供を制限。保健衛生上の危
害の発生拡大防止のため必要なときは、再生医療等の提供の一時停止など応急措置を命令。
○ 厚生労働大臣は、定期的に再生医療等の実施状況について把握し、その概要について公表する。 - 特定細胞加工物の製造の許可等
○ 特定細胞加工物の製造を許可制(医療機関等の場合には届出)とし、医療機関が特定細胞加工物の製造を委託する場合には、許可等を受けた者又は届出をした者に委託しなければならないこととする。
- リスクに応じた再生医療等の提供計画を厚生労働大臣に提出することが義務化。
- 医療機関が自院で治療用の細胞加工物を製造する場合は、厚生労働大臣への届出が必要。
- 届出を行わずに治療や細胞加工を行った場合、本法律により罰則が科されます。
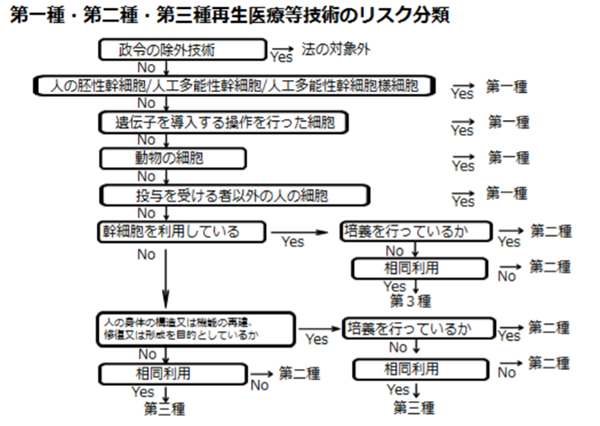
PRP療法は第三種再生医療等技術
再生医療等技術の分類について 法においては、再生医療等技術を第一種再生医療等技術、第二種再生医療等技術又は 第三種再生医療等技術の3つに分類し、それぞれに応じた手続を定めることとしている。
法第2条第7項において、「第三種再生医療等技術」とは、第一種再生医療等技術及び 第二種再生医療等技術以外の再生医療等技術をいうこととしており、第一種再生医療等 技術及び第二種再生医療等技術に該当しない場合は、第三種再生医療等技術となる。
加工について
法第2条第4項
この法律において「細胞加工物」とは、人又は動物の細胞に培養その他の加工を施したも
のをいい、「特定細胞加工物」とは、再生医療等に用いられる細胞加工物のうち再生医療等
製品であるもの以外のものをいい、細胞加工物について「製造」とは、人又は動物の細胞に
培養その他の加工を施すことをいい、「細胞培養加工施設」とは、特定細胞加工物の製造を
する施設をいう。
(加工の定義)
法第2条第4項に定める「加工」とは、細胞・組織の人為的な増殖・分化、細胞の株化、
細胞の活性化等を目的とした薬剤処理、生物学的特性改変、非細胞成分との組み合わせ又は
遺伝子工学的改変等を施すことをいう。組織の分離、組織の細切、細胞の分離、特定細胞の
単離(薬剤等による生物学的・化学的な処理により単離するものを除く。)、抗生物質によ
る処理、洗浄、ガンマ線等による滅菌、冷凍、解凍等は「加工」とみなさない(ただし、本
来の細胞と異なる構造・機能を発揮することを目的として細胞を使用するものについてはこ
の限りでない 。)。
細胞培養加工施設の遵守事項
法第2条第8項
「特定細胞加工物製造事業者」とは、特定細胞加工物の製造の許可若しくは認定を受けた者又は特
定細胞加工物の製造の届出をした者をいう。
- 国内の医療機関等以外で製造を行う場合 : 許可
- 国外で製造を行う場合 : 認定
- 国内の医療機関等内で製造を行う場合 : 届出
※ 許可、認定及び届出については細胞培養加工施設ごとに必要
構造設備基準(法第42条)
細胞培養加工施設の構造設備は、構造設備に係る基準に適合したものでなければならない
製造管理・品質管理等の基準(法第44条)
特定細胞加工物製造事業者は、製造管理・品質管理等の基準を遵守しなければならない (基準の内容)細胞加工物の製造及び品質管理の方法、試験検査の実施方法、保管の方法等
法第42条に基づく構造設備基準
細胞培養加工施設の構造設備基準(抜粋)
| 細胞培養加工施設の構造 | 必要な設備及び器具の配置、清掃及び保守、衛生設備、保管等区域の区 分 |
| 作業所 | 照明及び換気、不潔な場所からの区別、面積、防じん、防虫及び防その ための構造又は設備、廃水・廃棄物の処理に要する設備又は器具、有毒 ガスを取り扱う場合の処理設備 |
| 作業室 | 必要な構造及び設備、排水設備の構造、天井の構造、パイプ、ダクト等 の構造 |
| 作業室又は作業管理区域 | 温度及び必要に応じて湿度の維持管理できる構造及び設備 |
| 清浄度管理区域 | 天井、壁及び床の清掃性、設備及び器具の滅菌又は消毒、排水設備の構 造、排水口を設置していないこと |
| 無菌操作等区域 | 天井、壁及び床の清掃性、設備及び器具の滅菌又は消毒、排水設備の構 造、排水口を設置していないこと、流しを設置していないこと |
| 貯蔵設備 | 恒温装置、温度計その他必要な計器の設置 |
| 試験検査 |
法第44条に基づく製造管理・品質管理等の基準
- 品質リスクマネジメント(省令第92条)
- 製造部門及び品質部門(省令第93条)
- 施設管理者(省令第94条)
- 職員(省令第95条)
- 特定細胞加工物標準書(省令第96条)
- 手順書等(省令第97条)
- 特定細胞加工物の内容に応じた構造設備(省令第98条)
- 製造管理(省令第99条)
- 品質管理(省令第100条)
- 特定細胞加工物の取扱い(省令第101条)
- 検証又は確認(省令第102条)
- 特定細胞加工物の品質の照査(省令第103条)
- 変更の管理(省令第104条)
- 逸脱の管理(省令第105条)
- 品質等に関する情報及び品質不良等の処理(省令第106条)
- 重大事態報告等(省令第107条)
- 自己点検(省令第108条)
- 教育訓練(省令第109条)
- 文書及び記録の管理(省令第110条)
重大事態報告及び定期報告
重大事態報告(省令第107条)
特定細胞加工物製造事業者は、特定細胞加工物の安全性の確保に重大な影響を及ぼすおそれ
がある事態が生じた場合には、必要な措置を講じるとともに、その旨を速やかに以下の機関等
に報告しなければならない。
| 許可又は届出事業者 | 特定細胞加工物の提供先の再生医療等提供機関及び地方厚生局長 |
| 認定事業者 | 特定細胞加工物の提供先の再生医療等提供機関及び厚生労働大臣 |
定期報告(省令第112条)
特定細胞加工物製造事業者は、特定細胞加工物の製造の状況について、次に掲げる事項を、 報告しなければならない。
- 特定細胞加工物の製造件数
- 苦情の処理状況
- 特定細胞加工物の提供先の再生医療等提供機関から第17条第4項第1号の規程により通知を受け た疾患等の発生に係る次に掲げる情報イ 疾患等の発生があった年月日
ロ 疾患等の発生に対する措置状況
ハ 特定細胞加工物製造事業者による対策等
報告先:許可又は届出事業者は地方厚生局長、認定事業者は厚生労働大臣
報告期限:許可又は認定を受けた日若しくは届出をした日から起算して、1年毎に、当該期間満了 後60日以内に行わなければならない。
出典:再生医療等の安全性の 確保等に関する法律について